Aplicação sistémica de glutaminase: uma nova ferramenta para tratar o glioblastoma (GBM)
Terapia sistémica com glutaminase direcionada ao metabolismo do GBM, reduzindo a viabilidade tumoral e evitando o obstáculo da barreira hematoencefálica (BHE).
CONTEXTO
O glioblastoma (GBM) é o tumor cerebral mais agressivo e resistente ao tratamento, representando 54% dos gliomas e 16% de todos os tumores cerebrais primários. Com uma sobrevivência mediana de apenas 8 meses e uma taxa de mortalidade a cinco anos de 93%, as opções de tratamento atuais — incluindo cirurgia, radioterapia e quimioterapia — apresentam eficácia limitada. A adaptabilidade do GBM, a redundância nos mecanismos de transporte de glutamina e a sua dependência da captação externa de glutamina tornam-no altamente resistente às terapias tradicionais.
Apesar dos significativos investimentos em I&D, a maioria das terapias experimentais falha devido a problemas de penetração na barreira hematoencefálica e à plasticidade metabólica do tumor. O elevado custo económico, com despesas de tratamento entre 95.000 e 268.000 dólares por paciente por ano, reforça a necessidade de soluções terapêuticas inovadoras, eficazes e escaláveis.
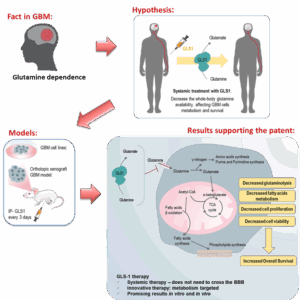
A nossa nova terapia sistémica com glutaminase (GLS1) representa uma mudança de paradigma no tratamento do GBM, ao visar a dependência metabólica do tumor da glutamina em vez de depender da penetração direta no tumor. Atuando na corrente sanguínea para esgotar a glutamina circulante, esta abordagem priva as células tumorais de nutrientes enquanto poupa os tecidos saudáveis, constituindo uma alternativa disruptiva e mais eficaz face às terapias atuais para o GBM.
SOBRE A TECNOLOGIA
A terapia sistémica baseada em biológicos explora a dependência única do GBM da glutamina, uma vulnerabilidade metabólica crítica. Ao contrário dos tratamentos convencionais que requerem penetração na BHE, a nossa terapia GLS1 atua na corrente sanguínea, esgotando a glutamina de forma sistémica e comprometendo assim o crescimento e sobrevivência do tumor.
Mecanismo de Ação
Adição à Glutamina no GBM:
As células tumorais não possuem glutamina sintetase e sobre-expressam transportadores de glutamina, tornando-se totalmente dependentes da captação externa de glutamina.
Esgotamento Sistémico da Glutamina:
A GLS1 degrada enzimaticamente a glutamina circulante, perturbando o metabolismo tumoral e induzindo a morte celular.
Privação Seletiva do Tumor:
As células saudáveis, que mantêm a capacidade de sintetizar glutamina, permanecem inalteradas, reduzindo significativamente a toxicidade sistémica.
Validação Pré-Clínica
✔ Eficácia in vitro
A terapia GLS1 induziu significativamente a morte de células de GBM e suprimiu a proliferação em várias linhas celulares de GBM.
A análise metabólica confirmou a interrupção das vias dependentes da glutamina essenciais para a sobrevivência tumoral.
✔ Eficácia in vivo (modelo murino de GBM)
Os ratinhos tratados com GLS1 apresentaram um aumento da sobrevivência mediana de 27 para 56 dias (p = 0,0212).
Foi observada redução do volume tumoral e da vascularização do tumor, sugerindo comprometimento da angiogénese tumoral.
A histopatologia confirmou uma redução significativa na atividade mitótica das células tumorais.
✔ Perfil de Segurança
Não foram observadas alterações morfológicas nos tecidos hepático e renal, indicando toxicidade sistémica mínima.
Os ratinhos tratados apresentaram menor perda de peso, sugerindo redução da caquexia e melhor estado fisiológico geral.
Figura 1. Aproveitar a dependência do glioblastoma (GBM) da glutamina para conceber uma terapia baseada no metabolismo. O esgotamento do meio de cultura das linhas celulares de GBM e o condicionamento sistémico dos modelos murinos de GBM induzem um remodelamento metabólico que conduz a uma diminuição da sobrevivência das células de GBM e do volume tumoral, com um aumento concomitante da sobrevivência dos modelos animais.
ESTÁGIO DE DESENVOLVIMENTO
A tecnologia encontra-se no TRL 3 — prova inicial de conceito demonstrada em modelos in vitro e in vivo limitados.
- Eficácia in vitro confirmada em várias linhas celulares de GBM.
- Eficácia in vivo validada em modelo murino ortotópico de GBM, com prolongamento da sobrevivência e redução da carga tumoral.
- Perfil de segurança favorável observado, sem toxicidade significativa fora do alvo.
Os próximos passos incluem validação pré-clínica adicional (TRL 4–5), com foco na otimização da dose, no aprofundamento do perfil de segurança e no alinhamento regulatório para transição para fase clínica.
APLICAÇÕES
- Tratamento do Glioblastoma — Terapia de primeira linha ou combinada na gestão do GBM.
- Outros Cancros Dependentes da Glutamina — Potencial para cancro do pulmão, pâncreas e colorretal, onde a sobre-expressão de transportadores de glutamina e a inibição da glutamina sintetase indicam dependência metabólica.
- Doenças Neurodegenerativas — Investigação em aplicações onde alterações no metabolismo da glutamina contribuem para a progressão da doença.
BENEFÍCIOS
- Sem necessidade de penetração na BHE — Priva os tumores de nutrientes eficazmente sem atravessar a barreira hematoencefálica.
- Alvo seletivo do tumor — Explora uma vulnerabilidade metabólica única das células de GBM.
- Toxicidade sistémica mínima — Terapia GLS1 bem tolerada, preservando células saudáveis enquanto compromete o metabolismo tumoral.
- Potencial oncológico amplo — Aplicável a outros cancros dependentes da glutamina, como pulmão, pâncreas e colorretal.
As terapias atuais para o GBM enfrentam eficácia limitada, efeitos secundários significativos e altas taxas de recidiva devido às restrições da BHE e à adaptabilidade metabólica tumoral. A nossa terapia sistémica GLS1 oferece múltiplas vantagens em relação às soluções existentes:
- Potencial de sobrevivência aumentado — Disrupção direta da dependência metabólica do GBM da glutamina, potencialmente prolongando a sobrevivência do paciente.
- Intervenção metabólica direcionada — Ao contrário dos inibidores de glutaminase intracelular ou bloqueadores de transporte de glutamina, a nossa terapia evita a BHE e elimina sistemicamente a disponibilidade de glutamina, privando o tumor de um nutriente chave.
- Toxicidade minimizada — As células saudáveis são poupadas, evitando os efeitos secundários graves observados em abordagens sistémicas anteriores como os híbridos glutaminase-asparaginase, que falharam devido à toxicidade.
- Nova abordagem metabólica sistémica — Ao contrário das terapias metabólicas existentes que tentam inibir vias intracelulares, a terapia GLS1 elimina a glutamina na origem, constituindo uma abordagem inédita de disrupção metabólica para o GBM.
PROPRIEDADE INTELECTUAL
- WO2025057133 (Data de Prioridade: 14/09/2023)
MAIS INFORMAÇÃO
Martins, F., van der Kellen, D., Gonçalves, L. G., & Serpa, J. (2023). Metabolic Profiles Point Out Metabolic Pathways Pivotal in Two Glioblastoma (GBM) Cell Lines, U251 and U-87MG. Biomedicines, 11(7), 2041. https://doi.org/10.3390/biomedicines11072041
Nunes, S. C., Sousa, J., Silva, F., Silveira, M., Guimarães, A., Serpa, J., Félix, A., & Gonçalves, L. G. (2023). Peripheral Blood Serum NMR Metabolomics Is a Powerful Tool to Discriminate Benign and Malignant Ovarian Tumors. Metabolites, 13(9), 989. https://doi.org/10.3390/metabo13090989
Brito, C., Azevedo, A., Esteves, S. et al. Clinical insights gained by refining the 2016 WHO classification of diffuse gliomas with: EGFR amplification, TERT mutations, PTEN deletion and MGMT methylation. BMC Cancer 19, 968 (2019). https://doi.org/10.1186/s12885-019-6177-0
Pinho JO, Matias M, Marques V, Eleutério C, Fernandes C, Gano L, Amaral JD, Mendes E, Perry MJ, Moreira JN, Storm G, Francisco AP, Rodrigues CMP, Gaspar MM. Preclinical validation of a new hybrid molecule loaded in liposomes for melanoma management. Biomed Pharmacother. 2023 Jan;157:114021. doi: 10.1016/j.biopha.2022.114021. Epub 2022 Nov 16. PMID: 36399831.
OPORTUNIDADE
- Procuramos parcerias estratégicas para:
- Parcerias de co-desenvolvimento — Colaboração com empresas farmacêuticas e de biotecnologia especializadas em terapias biológicas para avançar o desenvolvimento pré-clínico e clínico da terapia GLS1.
- Acordos de licenciamento — Tecnologia disponível para licenciamento para tradução clínica e comercialização.
NOVA Inventors
Jacinta Serpa
Filipa Martins
David Van der Kellen
Fernanda Silva
Sofia Fernandes